法老之蛇显灵!世界上超诡异的科学现象
发布时间: 浏览: 次 作者:www.tl6.net
科学解码:
“法老之蛇“是一种化学反应。
是膨胀反应里最有名的一个。
硫氰化汞受热分解,方程式:
4Hg(SCN)₂=4HgS+2CS₂+3(CN)₂↑+N₂↑,
反应过程非常震撼,就像一条巨蛇凭空生成。
有多种不同实验物的版本,但结果类似。
▲硫氰酸汞▼若接触到足够的热源,会有快速的放热反应,产生大量如蛇一样卷曲的固体,此一现象称为法老之蛇。
由于此特殊现象,硫氰酸汞曾被用在爆竹中。
硫氰酸汞在燃烧时会有不明显的火焰,可能是蓝色、黄色或橙色。
形成的固体产物颜色可以从深灰色到浅棕色不等,其内部颜色一般会比外层要暗。
该反应的方程式为:
弗里德里希·维勒在1821年第一次合成硫氰酸汞时,就已经发现此一性质:“(燃烧后)的产物会像虫一様卷曲,体积较原来增加很多,颜色类似石墨的灰色,但浅很多。
”德国一度有贩卖一种名为“Pharaoschlange”的爆竹,但后来因为有孩童误食爆竹燃烧后的固体后死亡,发现燃烧后的产物有毒,后来已禁止贩售。
后来有一种称为黑蛇的爆竹,燃烧后的效果类似法老之蛇,但效果较弱。
黑蛇的组成成分的毒性较弱,一般是由碳酸氢钠和糖或是由亚麻仁油和萘的混合物所构成。

初中化学:知识点笔记整理归纳

第一部分1、碳素钢可分为三种:高碳钢、中碳钢、低碳钢。
2、常用于炼铁的铁矿石有三种:(1)赤铁矿(主要成分为Fe2O3);(2)磁铁矿(Fe3O4);(3)菱铁矿(FeCO3)。
3、炼钢的主要设备有三种:转炉、电炉、平炉。
4、常与温度有关的三个反应条件是:点燃、加热、高温。
5、不饱和溶液变饱和溶液有三种方法:降温、加溶质、恒温蒸发溶剂;饱和溶液变不饱和溶液有两种方法:(1)升温。
(2)加溶剂;(注意:溶解度随温度而变小的物质如:氢氧化钙溶液由饱和溶液变不饱和溶液:降温、加溶剂;不饱和溶液变饱和溶液有三种方法:升温、加溶质、恒温蒸发溶剂)。
6、收集气体一般有三种方法:排水法、向上排空法、向下排空法。
7、水污染的三个主要原因:(1)工业生产中的废渣、废气、废水;(2)生活污水的任意排放;(3)农业生产中施用的农药、化肥随雨水流入河中。
8、通常使用的灭火器有三种:泡沫灭火器;干粉灭火器;液态二氧化碳灭火器。
9、固体物质的溶解度随温度变化的情况可分为三类:(1)大部分固体物质溶解度随温度的升高而增大;(2)少数物质溶解度受温度的影响很小;(3)极少数物质溶解度随温度的升高而减小。
10、CO2可以灭火的原因有三个:不能燃烧、不能支持燃烧、密度比空气大。
11、单质可分为三类:金属单质;非金属单质;稀有气体单质。
12、当今世界上最重要的三大矿物燃料是:煤、石油、天然气。
13、应记住的三种黑色氧化物是:氧化铜、二氧化锰、四氧化三铁。
14、氢气和碳单质有三个相似的化学性质:常温下的稳定性、可燃性、还原性。
15、教材中出现的三次淡蓝色:(1)液态氧气是淡蓝色;(2)硫在空气中燃烧有微弱的淡蓝色火焰;(3)氢气在空气中燃烧有淡蓝色火焰。
16、与铜元素有关的三种蓝色:(1)硫酸铜晶体;(2)氢氧化铜沉淀;(3)硫酸铜溶液。
17、过滤操作中有“三靠”:(1)漏斗下端紧靠烧杯内壁;(2)玻璃棒的末端轻靠在滤纸三层处;(3)盛待过滤液的烧杯边缘紧靠在玻璃捧引流。
18、三大气体污染物:SO2、CO、NO2。
19、酒精灯的火焰分为三部分:外焰、内焰、焰心,其中外焰温度最高。
20、取用药品有“三不”原则:(1)不用手接触药品;(2)不把鼻子凑到容器口闻气体的气味;(3)不尝药品的味道。
第二部分1、木炭在氧气中燃烧:C+O2点燃CO22、硫在氧气中燃烧:S+O2点燃SO23、镁在空气中燃烧:2Mg+O2点燃2MgO4、铁在氧气中燃烧:3Fe+2O2点燃Fe3O45、磷在氧气中燃烧:4P+5O2点燃2P2O56、铜在空气中加热:2Cu+O2加热2CuO7、氢气在氧气中燃烧:2H2+O2点燃2H2O8、一氧化碳在空气中燃烧:2CO+O2点燃2CO29、碳不充分燃烧:2C+O2(不充分)点燃2CO10、二氧化碳通过灼热的碳层:CO2+C高温2CO11、二氧化碳与水反应:CO2+H2O=H2CO312、生石灰和水化合:CaO+H2O=Ca(OH)213、氯酸钾与二氧化锰共热(实验室制O2):
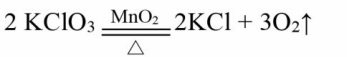 14、加热高锰酸钾:2KMnO4加热K2MnO4+MnO2+O2↑ 15、电解水:2H2O通电2H2↑+O2↑16、碳酸不稳定分解:H2CO3=H2O+CO2↑17、高温煅烧石灰石:CaCO3高温CaO+CO2↑18、锌和稀硫酸反应(实验室制H2):Zn+H2SO4=ZnSO4+H2↑19、锌和盐酸的反应:Zn+2HCl=ZnCl2+H2↑20、铁和盐酸:Fe+2HCl=FeCl2+H2↑第三部分1、常见物质的颜色:多数气体为无色,多数固体化合物为白色,多数溶液为无色。
14、加热高锰酸钾:2KMnO4加热K2MnO4+MnO2+O2↑ 15、电解水:2H2O通电2H2↑+O2↑16、碳酸不稳定分解:H2CO3=H2O+CO2↑17、高温煅烧石灰石:CaCO3高温CaO+CO2↑18、锌和稀硫酸反应(实验室制H2):Zn+H2SO4=ZnSO4+H2↑19、锌和盐酸的反应:Zn+2HCl=ZnCl2+H2↑20、铁和盐酸:Fe+2HCl=FeCl2+H2↑第三部分1、常见物质的颜色:多数气体为无色,多数固体化合物为白色,多数溶液为无色。2、一些特殊物质的颜色:黑色:MnO2、CuO、Fe3O4、C、FeS(硫化亚铁)蓝色:CuSO4·5H2O、Cu(OH)2、CuCO3、含Cu2+ 溶液、液态固态O2(淡蓝色)红色:Cu(亮红色)、Fe2O3(红棕色)、红磷(暗红色)黄色:硫磺(单质S)、含Fe3+ 的溶液(棕黄色)绿色:FeSO4·7H2O、含Fe2+的溶液(浅绿色)、碱式碳酸铜[Cu2(OH)2CO3]无色气体:N2、CO2、CO、O2、H2、CH4有色气体:Cl2(黄绿色)、NO2(红棕色)有刺激性气味的气体:NH3(此气体可使湿润pH试纸变蓝色)、SO2有臭鸡蛋气味:H2S3、常见一些变化的判断:①白色沉淀且不溶于稀硝酸或酸的物质有:BaSO4、AgCl(就这两种物质)②蓝色沉淀:Cu(OH)2、CuCO3③红褐色沉淀:Fe(OH)3Fe(OH)2为白色絮状沉淀,但在空气中很快变成灰绿色沉淀,再变成Fe(OH)3红褐色沉淀④沉淀能溶于酸并且有气体(CO2)放出的:不溶的碳酸盐⑤沉淀能溶于酸但没气体放出的:不溶的碱4、酸和对应的酸性氧化物的联系:①酸性氧化物和酸都可跟碱反应生成盐和水:CO2 +2NaOH==Na2CO3 +H2O(H2CO3 +2NaOH==Na2CO3 +2H2O)SO2 +2KOH==K2SO3 +H2OH2SO3 +2KOH==K2SO3 +2H2OSO3 +2NaOH==Na2SO4 +H2OH2SO4 +2NaOH==Na2SO4 +2H2O②酸性氧化物跟水反应生成对应的酸:(各元素的化合价不变)CO2 +H20==H2CO3 SO2 +H2O==H2SO3SO3 +H2O==H2SO4 N2O5 +H2O==2HNO3(说明这些酸性氧化物气体都能使湿润pH试纸变红色)5、碱和对应的碱性氧化物的联系:①碱性氧化物和碱都可跟酸反应生成盐和水:CuO+2HCl==CuCl2 +H2OCu(OH)2 +2HCl==CuCl2 +2H2OCaO+2HCl==CaCl2 +H2OCa(OH)2 +2HCl==CaCl2 +2H2O②碱性氧化物跟水反应生成对应的碱:(生成的碱一定是可溶于水,否则不能发生此反应)K2O+H2O==2KOH Na2O+H2O==2NaOHBaO+H2O==Ba(OH)2 CaO+H2O==Ca(OH)2③不溶性碱加热会分解出对应的氧化物和水:Mg(OH)2 ==MgO+H2O Cu(OH)2 ==CuO+H2O2Fe(OH)3 ==Fe2O3 +3H2O 2Al(OH)3 ==Al2O3 +3H2O6、实验用到的气体要求是比较纯净,除去常见杂质具体方法:①除水蒸气可用:浓流酸、CaCl2固体、碱石灰、无水CuSO4(并且可以检验杂质中有无水蒸气,有则颜色由白色→蓝色)、生石灰等②除CO2可用:澄清石灰水(可检验出杂质中有无CO2)、NaOH溶液、KOH溶液、碱石灰等③除HCl气体可用:AgNO3溶液(可检验出杂质中有无HCl)、石灰水、NaOH溶液、KOH溶液除气体杂质的原则:用某物质吸收杂质或跟杂质反应,但不能吸收或跟有效成份反应,或者生成新的杂质。
7、实验注意的地方:①防爆炸:点燃可燃性气体(如H2、CO、CH4)或用CO、H2还原CuO、Fe2O3之前,要检验气体纯度。
②防暴沸:稀释浓硫酸时,将浓硫酸倒入水中,不能把水倒入浓硫酸中。
③防中毒:进行有关有毒气体(如:CO、SO2、NO2)的性质实验时,在通风厨中进行;并要注意尾气的处理:CO点燃烧掉;SO2、NO2用碱液吸收。
④防倒吸:加热法制取并用排水法收集气体,要注意熄灯顺序。
8、常见意外事故的处理:①酸流到桌上,用NaHCO3冲洗;碱流到桌上,用稀醋酸冲洗。
②沾到皮肤或衣物上:Ⅰ、酸先用水冲洗,再用3-5%NaHCO3冲洗;Ⅱ、碱用水冲洗,再涂上硼酸;Ⅲ、浓硫酸应先用抹布擦去,再做第Ⅰ步。
9、实验室制取三大气体中常见的要除的杂质:①制O2要除的杂质:水蒸气(H2O)②用盐酸和锌粒制H2要除的杂质:水蒸气(H2O)、氯化氢气体(HCl,盐酸酸雾)(用稀硫酸没此杂质)③制CO2要除的杂质:水蒸气(H2O)、氯化氢气体(HCl)除水蒸气的试剂:浓流酸、CaCl2固体、碱石灰(主要成份是NaOH和CaO)、生石灰、无水CuSO4(并且可以检验杂质中有无水蒸气,有则颜色由白色→蓝色)等除HCl气体的试剂:AgNO3溶液(并可检验出杂质中有无HCl)、澄清石灰水、NaOH溶液(或固体)、KOH溶液(或固体)[生石灰、碱石灰也可以跟HCl气体反应]10、有CO的验证方法:(先验证混合气体中是否有CO2,有则先除掉)将混合气体通入灼热的CuO,再将经过灼热的CuO的混合气体通入澄清石灰水。
现象:黑色CuO变成红色,且澄清石灰水要变浑浊。